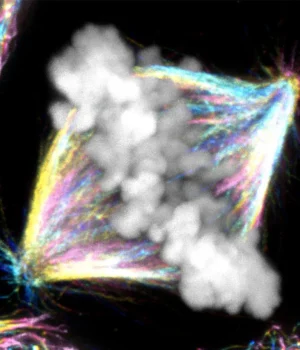
Cientistas do Instituto Ruder Bosković (RBI) em Zagreb, Croácia, descobriram uma função surpreendente para a proteína CENP-E. Durante anos, pensou-se que ele agia como um motor que movia os cromossomos errantes para a posição correta enquanto uma célula se preparava para se dividir. As novas descobertas revelam algo completamente diferente: o CENP-E estabiliza as primeiras conexões entre os cromossomos e as “trilhas” internas da célula, ajudando-as a se alinharem corretamente antes que a célula se divida.
Um estudo complementar descobriu que os centrômeros, pequenas estruturas nos cromossomos que antes se acreditava funcionarem por conta própria, desempenham um papel no direcionamento do CENP-E para ajudar o processo de divisão a se desenvolver adequadamente. Juntas, estas descobertas anulam duas décadas de ensinamentos aceites e têm implicações importantes, uma vez que erros no alinhamento dos cromossomas estão ligados a muitos cancros e doenças genéticas.
Por que o posicionamento precoce dos cromossomos é importante
A cada momento, em inúmeras células do corpo, a divisão ocorre com extraordinária precisão. Uma única célula copia três bilhões de letras de DNA e consegue distribuir a cópia perfeita para ambas as células-filhas.
Quando esse processo delicado falha, as consequências podem ser terríveis. Mesmo um cromossomo no lugar errado pode atrapalhar o desenvolvimento, contribuir para a infertilidade ou desencadear o câncer. A divisão celular oferece pouco espaço para erros.
Durante anos, os pesquisadores acreditaram ter compreendido um dos atores centrais: o CENP-E, frequentemente descrito como uma proteína motora que move cromossomos errantes entre células em divisão. O conceito era simples, amplamente ensinado e, em última análise, errado.
Pesquisadores descobriram um papel diferente para o CENP-E
Dois estudos RBI, publicados na Nature Communications e liderados pelo Dr. Kruno Vukusic e pela Professora Eva Tolic, quebram o modelo anterior e apresentam uma nova explicação. Dr. Vukusic treinou como pesquisador de pós-doutorado dentro de uma equipe altamente seletiva do ERC Synergy e agora está se preparando para liderar seu próprio grupo no RBI. O Professor Tolich, um reconhecido especialista mundial em biofísica celular e chefe do Laboratório de Biofísica Celular do RBI, possui duas bolsas ERC e é membro da EMBO e da Academia Europaea. O seu trabalho mostra que o CENP-E não é um “músculo” que puxa os cromossomas para o seu lugar, mas um regulador chave que é ativado no momento certo para permitir que todo o resto se alinhe.
“O CENP-E não é o motor que puxa os cromossomos para o centro”, diz Vukušić. “É o fator que garante que eles possam se conectar corretamente. Sem essa estabilidade inicial, o sistema para.”
Movimento cromossômico como uma cidade de trânsito
Imagine uma cidade enorme em pleno trânsito. Milhões de veículos ocupam inúmeros cruzamentos e um erro pode interromper todo o fluxo.
Agora imagine esta cena ampliada para o interior de uma sala. Os cromossomos agem como trens de carga de DNA e os microtúbulos formam seus trilhos-guia. Para que a divisão seja bem-sucedida, cada cromossomo deve se conectar à trilha correta e mover-se para a posição central.
O modelo crônico vê o CENP-E como uma locomotiva que puxa os cromossomos atrasados para o lugar. A equipa de Zagreb encontrou funções mais específicas. Em vez de um mecanismo, o CENP-E se comporta como um linker que assegura a conexão entre um cromossomo e os microtúbulos. Quando esse acoplamento é fraco ou ausente, os trens param na periferia das estações e não podem prosseguir.
O que controla quando os cromossomos se movem?
Por que alguns cromossomos param nas extremidades das células? A resposta envolve aurora quinases, um grupo de proteínas que agem como verdadeiros semáforos. Eles produzem fortes sinais “vermelhos” que evitam que os cromossomos façam falsas ligações primárias.
Este sistema protege as células do desalinhamento próximo aos pólos, mas pode reter os cromossomos de forma muito agressiva. O CENP-E ajuda a restaurar o equilíbrio ajustando esses sinais para que as primeiras conexões corretas possam ser feitas. Uma vez que surge a ligação estável inicial, o alinhamento segue naturalmente através da geometria do fuso e do comportamento dos microtúbulos.
“Não se trata de força bruta”, explica Tolick. “Trata-se de criar as condições para que o sistema funcione sem problemas. O papel principal do CENP-E é estabilizar a iniciação e, quando isso acontecer, o resto da mitose se desenrola adequadamente.”
Repensando um modelo de livro didático de longa data
Por quase vinte anos, os livros didáticos descreveram o CENP-E como um motor que arrasta os cromossomos para a placa metafásica. Novas pesquisas contradizem essa visão.
“O Congresso, o alinhamento dos cromossomos, está intrinsecamente ligado à bioorientação”, disse Tolick. “O que mostramos é que o próprio CENP-E não contribui significativamente para o movimento. Seu papel crítico é estabilizar inicialmente os anexos finais. É isso que permite que o sistema se mova adequadamente.”
Esta mudança substitui uma explicação baseada na força que se concentra no controle e no tempo. Seu impacto vai além da educação em sala de aula.
Por que esta descoberta é importante para a saúde humana
Para alguém de fora da área, a diferença pode parecer pequena. Na biologia celular, pequenas mudanças muitas vezes revelam verdades importantes. Erros na segregação cromossômica são uma marca registrada do câncer. As células tumorais normalmente apresentam segmentos cromossômicos duplicados ou ausentes, e essas anormalidades são frequentemente atribuídas a erros no processo de splicing.
Ao demonstrar que o CENP-E regula as primeiras adesões e vincular esta regulação à atividade da Aurora quinase, a equipe de Zagreb vinculou dois processos que anteriormente se pensava que operavam separadamente. Esta ligação revela um potencial ponto fraco na divisão das células e pode apontar para terapias que corrigem ou retardam divisões perigosas.
“Não se trata apenas de reescrever um modelo”, diz Vukušić. “Trata-se de identificar um mecanismo que esteja diretamente ligado à doença. Isso abre a porta para o diagnóstico e para pensar em novas terapias”.
Apoio da Europa e da Croácia
A investigação foi possível graças a um financiamento competitivo significativo, incluindo a Bolsa Sinergia do Conselho Europeu de Investigação, a Fundação Científica Croata, o Projecto Bilateral Croata Suíço e o Programa de Desenvolvimento da UE.
O trabalho também conta com recursos computacionais avançados do Centro SRCE da Universidade de Zagreb. “A biologia moderna não consiste apenas em microscópios e tubos de ensaio”, disse Tolick. “É também computação e colaboração entre disciplinas e fronteiras.”
Encontrando estrutura na complexidade celular
Em sua essência, a descoberta esclarece como as células mantêm a ordem em constante movimento. Trilhões de divisões celulares ocorrem todos os dias no corpo humano, e cada evento deve lutar contra a atração natural da desordem. Novos insights de Zagreb ajudam a revelar uma das estratégias ocultas por trás dessa continuidade. Ao redefinir o papel do CENP-E e ligá-lo a outros reguladores celulares, a equipe acrescentou clareza a um mecanismo que opera sob enorme estresse.
“Ao descobrir como esses reguladores microscópicos cooperam”, disse Tolick, “não estamos apenas aprofundando a nossa compreensão da biologia, mas também nos aproximando da correção das falhas subjacentes às doenças”.